糖鎖による抗体ダイナミクスの制御機構を解明 ~分子経絡が抗体医薬設計の新たな鍵に~
  |
| 大学共同利用機関法人 国立大学法人 東京科学大学 公立大学法人 名古屋市立大学 ⼀般財団法人 国立大学法人 大阪大学 国立大学法人 |
糖鎖による抗体ダイナミクスの制御機構を解明
~分子経絡が抗体医薬設計の新たな鍵に~
自然科学研究機構(生命創成探究センター)の谷中冴子 准教授(現 東京科学大学 准教授)、加藤晃⼀ 教授(生命創成探究センター、名古屋市立大学)らは、抗体の糖鎖修飾、特にガラクトース付加が、抗体分子の構造と動態に及ぼす影響を原子レベルで解明しました。
本研究の成果は、国際科学雑誌 「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」(現地時間2025年8月5日)にオンライン掲載されました。
【発表のポイント】
私たちの体には、病原体から身を守るための免疫システムが備わっています。その中心的な役割を担うのが「免疫グロブリンG(IgG)」注1) と呼ばれる抗体です。IgGは、特定の抗原を認識して結合するだけでなく、Fc受容体や補体といったエフェクター分子との相互作用を通じて、様々な免疫応答を誘導します。本研究では、IgGのFc領域 注2) に結合した「糖鎖」の修飾が、IgGの動的な構造変化を制御し、その結果として免疫機能が調節されるメカニズムを、計算科学と実験科学を融合したアプローチで明らかにしました。特に、本研究では、糖鎖修飾による影響が、あたかも私達の体の中に張り巡らされた経絡のように、分子レベルで伝播していく「分子経絡」注3) の重要性に着目しました。
【研究の背景】
治療用抗体は、がんや自⼰免疫疾患など、さまざまな疾患の治療に用いられています。抗体の効果は、標的抗原への結合だけでなく、Fc領域を介したエフェクター機能 注4) の発揮によっても大きく左右されます。Fc領域の糖鎖修飾 注5) は、抗体のエフェクター機能を調節する重要な因子であり、そのメカニズム解明は、より効果的な抗体医薬品の開発につながると考えられています。
【本研究の手法と成果】
研究グループは、遺伝子工学的手法と酵素反応を組み合わせることで、糖鎖構造が異なるIgG1-Fcを調製しました。これらについて、安定同位体標識NMR分光法 注6) を用いてFc領域の動的構造を解析するとともに、分子動力学シミュレーション 注7) によって糖鎖修飾がFc領域のコンフォメーション変化に与える影響を評価しました。また、動的ネットワーク解析を用いて、「分子経絡」を同定しました。NMR分光法と分子動力学シミュレーションの結果から、ガラクトース 注8) 残基は糖鎖の動きを止める「錨」およびFc領域全体の動きを抑える「楔」としてはたらき、フコース 注9) 除去は特定のFc受容体との結合に関与するアミノ酸残基の動態を変化させることが明らかになりました。これらの結果は、糖鎖修飾がIgGのFc領域の動的構造を制御し、エフェクター機能を調節するメカニズムを原子レベルで理解する上で重要な知見となります。特に、「分子経絡」の存在は、糖鎖修飾の効果がFc領域全体に伝播する様子を示唆しています。
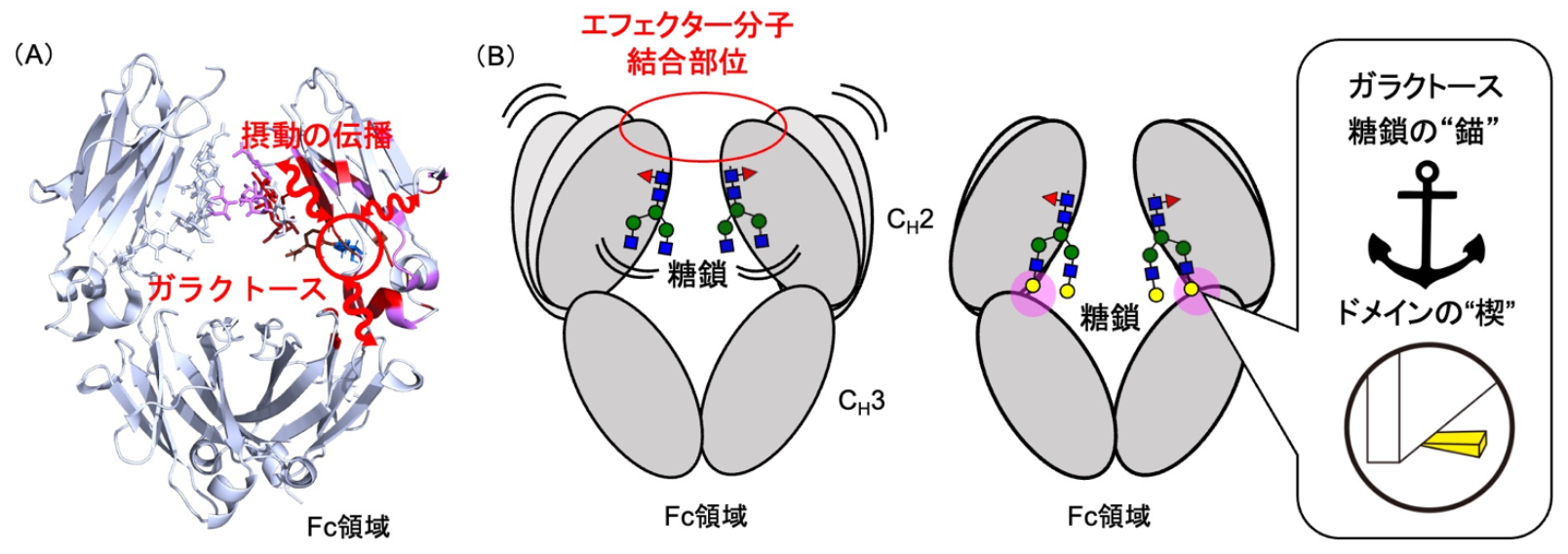
| (図)(A)糖鎖のガラクトース残基での構造変化がFc分子内を伝わる様子を示している。(B)ガラクトース残基(黄色の丸)は糖鎖の動きを止める「錨」およびFc領域全体の動きを抑える「楔」としてはたらき、エフェクター分子との相互作用を助けている。 |
【成果の意義および今後の展開】
本研究成果は、治療用抗体の開発において、Fc領域の糖鎖修飾を最適化するための合理的な設計基盤を提供します。今後は、糖鎖修飾と抗体の構造・機能相関に関するさらなる研究を進めることで、また「分子経絡」の操作という新たな視点を取り入れることで、より効果的かつ安全な抗体医薬品の開発に貢献できると期待されます。
【用語解説】
【論文情報】
| 掲載誌 | Proceedings of the National Academy of Sciences of the United States of America |
| タイトル | Exploring Glycoform-Dependent Dynamic Modulations in Human Immunoglobulin G via Computational and Experimental Approaches |
| 著者 | Saeko Yanaka, Yoshitake Sakae, Yohei Miyanoiri, Takumi Yamaguchi, Yukiko Isono, Sachiko Kondo, Miyuki Iwasaki, Masayoshi Onitsuka, Hirokazu Yagi, Koichi Kato*(*責任著者) |
| DOI | 10.1073/pnas.2505473122 |
| 掲載日 | 2025年8月5日(米国時間) |
【著者情報】
東京科学大学 総合研究院 フロンティア材料研究所)
名古屋市立大学大学院薬学研究科)
【研究サポート】
本研究は、文部科学省科学研究費助成事業(JP20K15981 および JP23K24018 谷中冴子、JP19H01017 および JP24H00599 加藤晃⼀)、日本医療研究開発機構(AMED)(JP21ae0121020 および JP23ak0101209 谷中冴子、JP21ae0121013 加藤晃⼀)、文部科学省研究大学総合研究育成事業:研 究大学強化促進事業(CURE)課題番号JPMXP1323015488(Spin-LプログラムNo. spin24XN014)、生命創成探究センター共同利用研究(24EXC901、25EXC603)、および科学技術振興機構(JST)戦略的 創造研究推進事業(CREST)(JPMJCR21E3 加藤晃⼀)の助成を受けたものです。また、本研究は文部 科学省ナノテクノロジープラットフォーム事業(分子・物質合成)、大阪大学蛋白質研究所共同利用・共 同研究拠点 NMRCR-16-05, 17-05, 18-05, 19-05, 20-05, 21-05、計算科学研究センター(24-IMS-C197)、文部科学省先端研究設備共用促進事業(コアファシリティ構築支援プログラム)JPMXS0441500024、国際・産学連携インヴァースイノベーション材料創出(DEJI2MA)プロジェクト、およびヒューマングライコームプロジェクトの支援を受けて行われました。
令和7年8月5日
