2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて―
  |
北陸先端科学技術大学院大学 筑波大学 科学技術振興機構(JST) |
2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発
―免疫不全状態でも機能が期待されるがん治療に向けて―
【ポイント】
- T細胞やB細胞などの主要な免疫細胞に依存せずにがん細胞を攻撃する、新しいがん治療へのアプローチ「AUN(阿吽)」を開発
- 免疫機能が低下した状態でも抗腫瘍効果が期待される
- 社会実装に向け、スタートアップ創業を視野に研究を推進中
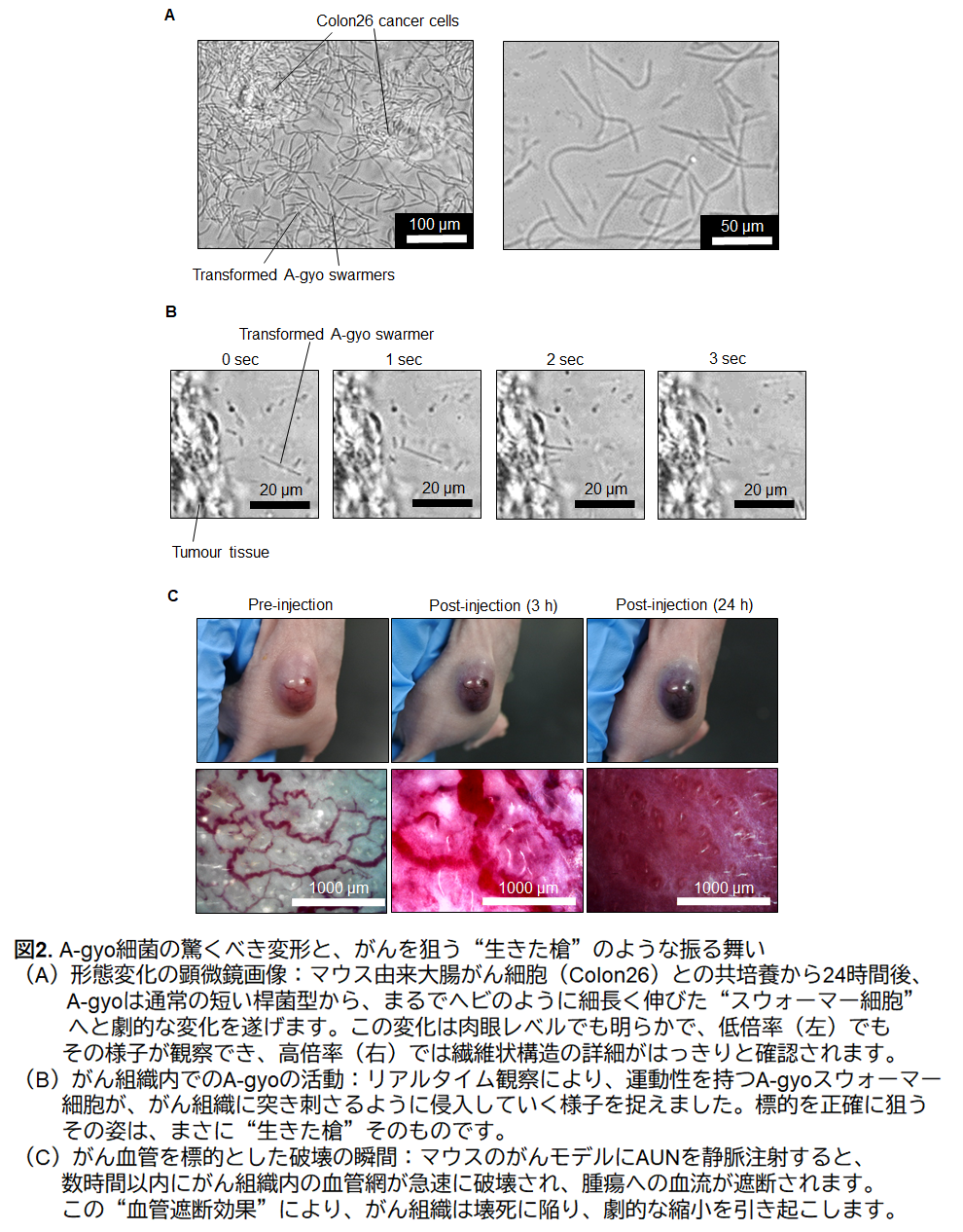
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授の研究グループは、第一三共株式会社(代表取締役社長兼CEO・奥澤宏幸、東京都中央区)ならびに筑波大学(学長・永田恭介、茨城県つくば市)生命環境系の高谷 直樹教授らとの共同研究によって、2種類の細菌がまるで"阿吽の呼吸"のように精緻に連携しながら、がん細胞を選択的に攻撃するという新たな治療へのアプローチ「AUN(阿吽)」の開発に成功しました。 研究チームが用いたのは、"AUN(阿吽)"と名付けられた2種の天然細菌:腫瘍内に常在するProteus mirabilis*1[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris*2[吽形(UN-gyo)]です(図1)。この互いに異なる機能を持つ2種の細菌が、それぞれの役割を果たしながら、以下の一連のプロセスを協調的に引き起こし、抗腫瘍効果を示すことが確認されました(図2にメカニズムの一部を提示)。まず、がん特有の環境に誘導されて、両細菌はマウス皮下腫瘍モデルにおいて腫瘍の血管やがん細胞を選択的に破壊。これにより、正常組織への影響を最小限に抑えつつ、がん組織だけを効果的に抑制する可能性が示唆されました。さらに、がんが産生する特異的な代謝物の存在下で、片方の細菌(A-gyo)は線維状の構造へと変化。この形態変化により抗腫瘍効果が一段と強化されることが判明しました。興味深いのは、経時的に両細菌の集団構成(ポピュレーション)も動的に変化し、最適な役割分担が自然に形成される点です。加えて、病原性を抑制しながら、重篤な副作用の原因となるサイトカインストーム*3の発生も回避できる可能性があるという点も特徴です。 本研究は、2種の細菌の持つ自然な"協調戦略"を巧みに活用することで、安全かつ効果的ながん治療の新たな道を拓くものです。今後、このメカニズムを応用した新しいがん治療法の社会実装に向けて、スタートアップ創業を計画しています。 本成果は、2025年8月5日にSpringer Nature社の発行するNature Biomedical Engineering誌のオンライン版に掲載されました。 |
【研究の背景と内容】
がん免疫療法は、1868年にドイツの医師Buschが細菌感染を意図的に引き起こしたがん患者の治癒例を報告したことに端を発し、1893年にはWilliam Coley博士が「細菌を用いたがん治療法」を提唱して以来、150年以上にわたり発展を続けています。Coley博士は「がん免疫療法の父」と称され、彼の遺志は現代の免疫チェックポイント阻害剤やCAR-T細胞治療へと受け継がれています。
しかしこれまで、細菌療法を含むがん免疫療法は「免疫細胞の力」が不可欠とされてきました。また、化学療法や放射線治療などの標準治療を受けたがん患者の多くが免疫不全状態にあり、このような状況では、免疫細胞の力が抑えられるため、効果が著しく制限されてきました。
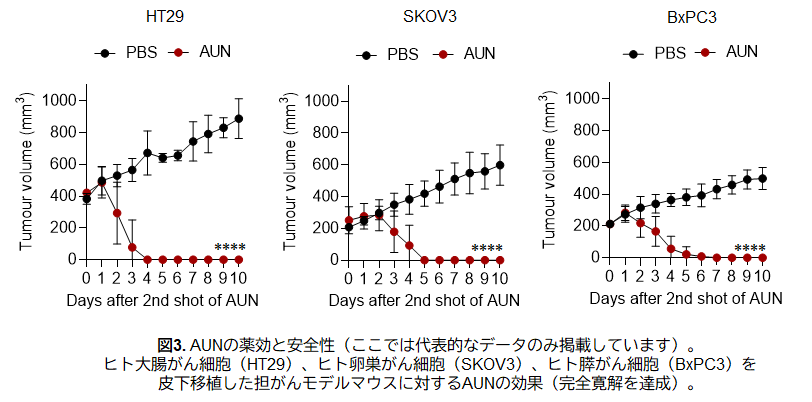
本研究では、T細胞やB細胞などの主要な免疫細胞に頼ることなくがんを攻撃する、世界でも類を見ない新しい治療へのアプローチを明らかにしました。登場するのは、"AUN(阿吽)"と名付けられた2種の天然細菌:腫瘍内に常在するProteus mirabilis[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris[吽形(UN-gyo)]です。この2種が"阿吽の呼吸"で共存することで、各種ヒトがん細胞を皮下移植した担がんモデルマウスに対して明確な腫瘍抑制効果を発揮しました(図3)。
そのメカニズムは極めてユニークで、まさに"阿吽の呼吸"のように2つの細菌が協調し、以下のような一連の現象を連携して引き起こします(図2にメカニズムの一部を提示)。
- 腫瘍血管とがん細胞の選択的破壊
- がん代謝物による阿形(A-gyo)の構造変化(線維状化)による抗腫瘍強化
- 細菌間の構成比率の変化による機能最適化(ポピュレーションシフト)
- 病原性の抑制と副作用の回避(サイトカインストームの軽減)
さらに、吽形(UN-gyo)は、阿形(A-gyo)と共存・混在することによって、両者の病原性を抑制しながら、がん細胞に対する特異的な毒性を高める"制御役"として機能する可能性があります。この2種の細菌が示す絶妙なバランスと相互作用こそが、腫瘍抑制効果の鍵となっている可能性があります。
【社会的インパクト】
この治療へのアプローチは、免疫不全状態にあるがん患者への新たな選択肢となる可能性があり、今後のさらなる研究と検証が期待されます。実際に、本研究では免疫細胞が機能しにくいマウスモデルやヒトがんモデルにおいても、細菌が自律的にがん細胞および腫瘍血管を標的として作用する様子が確認されました。このようなT細胞やB細胞といった"免疫細胞に依存しない"方法は、従来のがん免疫療法とは異なるアプローチとして注目されています。
また、本成果の社会実装を見据え、がん細菌療法の実用化に向けたスタートアップの創業準備も進行中です。150年以上前から構想されてきたがん細菌療法の概念に、新たな技術的進展を加えることで、その応用可能性を慎重かつ段階的に検討していく段階に入っています。
【論文掲載情報など】
本成果は、2025年8月5日に医学・薬学系ジャーナルのNature Biomedical Engineering誌のオンライン版に掲載されました。なお、本研究は、文部科学省 科学研究費補助金 基盤研究A(23H00551)、同 挑戦的研究(開拓)(22K18440、25K21827)、国立研究開発法人 科学技術振興機構(JST) 研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、同 大学発新産業創出基金事業 スタートアップ・エコシステム共創プログラム(JPMJSF2318)、同 次世代研究者挑戦的研究プログラム(SPRING) 未来創造イノベーション研究者支援プログラム(JPMJSP2102)、公益財団法人 発酵研究所、公益財団法人 上原記念生命科学財団、本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターならびに第一三共株式会社の支援のもと行われました。
【論文情報】
| 掲載誌 | Nature Biomedical Engineering |
| 論文題目 | Tumour-resident oncolytic bacteria trigger potent anticancer effects through selective intratumoural thrombosis and necrosis |
| 著者 | Seigo Iwata1, Taisei Nishiyama1, Matomo Sakari1, Yuki Doi2, Naoki Takaya2, Yusuke Ogitani3, Hiroshi Nagano3, Keisuke Fukuchi3, Eijiro Miyako1* 1 北陸先端科学技術大学院大学 2 筑波大学 3 第一三共株式会社 |
| 掲載日 | 2025年8月5日にオンライン版に掲載 |
| DOI | 10.1038/s41551-025-01459-9 |
【用語説明】
酸素の存在下および不在下の両方の環境で生存可能な腸内細菌科に属するグラム陰性桿菌(通性嫌気性菌)。運動性、鞭毛を有する数マイクロメートルの棒状の形態を有する。寒天培地上では、Swarming(群化)により独特の波状のコロニー(白色)を形成する特性がある。
酸素の有無に関わらず生存可能な通性嫌気性の紅色非硫黄細菌に属し、運動性のある数マイクロメートルの棒状のグラム陰性桿菌。また、バクテリオクロロフィルから成る光捕集タンパク質を介した光合成を行う。
サイトカインストームとは、体がウイルスや細菌などに反応して免疫物質(サイトカイン)を大量に放出しすぎることで起こる、過剰な免疫反応のこと。この反応が強すぎると、自分自身の体の組織を傷つけてしまい、重い症状や臓器不全を引き起こすことがある。
令和7年8月6日
